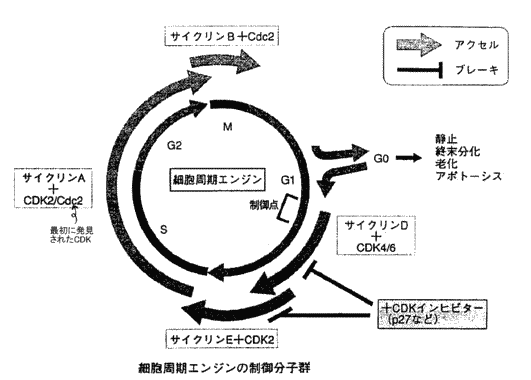
| �זE�����ƃ`�F�b�N�|�C���g |

| ��@�\���S�� | ||
| �@ | �E�ُ�����j�^�[���Č��o���錟�o���q | |
| �@ | �E���o�����ُ���C�����u�ɓ`���钇����q | |
| �@ | �E�C�����邢�͔j������ۂɍs���쓮���q | |
| ����ɂ�镪�ށ� | ||
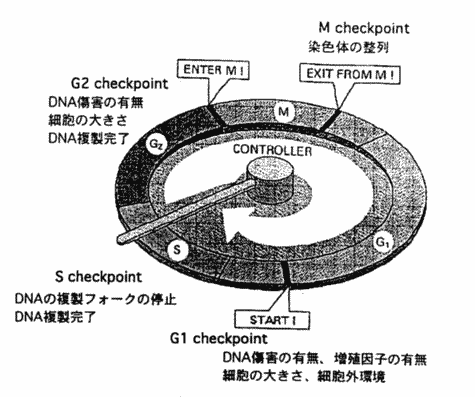
| �@ | �EG1���`�F�b�N�|�C���g�iG1��S�AG1/S�j | |
| �@ | �EG2���`�F�b�N�|�C���g�iG2��M�AG2/M�j | |
| �@ | �ES���`�F�b�N�|�C���g�iS��S�AS��G2�AS/G2�j | |
| �@ | �EM���`�F�b�N�|�C���g�i���������˕������j | |
| ��@�\�ɂ�镪�ށ� | ||
| �@ | �EDNA���Q�`�F�b�N�|�C���g �iDNA�ɑ����������Ԃŕ����╪�z���s����̂�h���j | |
| �@ | �EDNA�����`�F�b�N�|�C���g �iDNA�����S�ɕ��������O�ɍזE�������F�̂����z�����G���[��h���j | |
| �@ | �E�X�s���h���`�F�b�N�|�C���g �i�a���������m�ɏW�����A���ׂĂ̐��F�̓����̂ɕt������܂ŕ������N���Ȃ��悤�ɂ���j | |
| �� ���C�Z���X���Ƃ́A�זE�����̊Ԃɕ�����1���N���Ȃ����Ƃ�ۏ��郁�J�j�Y���B���Ȃ킿�AS���̌��M�����o�Ȃ���A����S�������������Ƃ��ł��Ȃ��V�X�e���B |
| MIN�imicrosatellite instability�j��CIN�ichromosomal instability�j ����זE�̒��ŁA�}�C�N���T�e���C�g�}�[�J�[�ȂǁA�V�[�N�G���X���x���ł̕s���萫���������̂ƁA���F�̂̐��̕ω��ȂǑ傫�ȕs���萫�����̂�����B�O�҂̓~�X�}�b�`��`�q�̌�������Ȃǂɂ悭�����A��҂̓X�s���h���`�F�b�N�|�C���g�Ɉُ������������ɂ悭������B���̊ӕʂ́A�����Ǐd���j�Q�������ŕ��邩�ǂ����Ŕ���ł���B |
| �� �a�����͔����ǂłł��Ă���̂ŁA�����Ǐd���j�Q�܂�������A���F�̂��ԓ��ʂɐ��邱�Ƃ��ł����A�X�s���h���`�F�b�N�|�C���g�������āA���������ōזE��������~����B |
| �זE�����Ɗ��Ƃ��Ȃ�RB�^���p�N����p53 |
| DNA�C���\�Ɍ���������������ѐ��F�̕s���萫���������� |
| �@ | ���� | ���DNA�̕ω� | |
| ���I�ȗv�� | DNA�����G���[ | �~�X�y�A�E�t���[���V�t�g | |
| ����̌ݕψِ� | �~�X�y�A | ||
| �E����� | �~�X�y�A | ||
| �_���I���� | �~�X�y�A�E2�{���ؒf | ||
| �O �I �� �v �� | �����I�v�� | ���O�� | �V�N���u�^���^�s���~�W���_�C�}�[ �i6-4�j���Y�� |
| �d�����ː��iX���E�����j | 1�{���ؒf�E2�{���ؒf | ||
| ���w�I�v�� | �A���L������ | �A���L�������� | |
| �ˋ��� | �����ˋ��E���ԉˋ� | ||
| �����̒��ړI�E �t�I�ȏC�� | �s���~�W���_�C�}�[�̌��� |
| �A���L��������̒E�A���L���� | |
| 2�{���ؒf�̍Č��� | |
| �����C�� | ������C�� |
| �k�N���I�`�h�����C�� | |
| �~�X�}�b�`�C�� | |
| �g�����C�� | ������C�� |
| �����I�g�����ɂ��2�{���ؒf�̌��� | |
| ���I�g�����ɂ�閖�[���� |
| �@ | �@�\ | �����Ɋ֗^���� ��ȃ^���p�N���q | �e�o�H�ɂ�� �����鎾�� |
| ������C�� �iBER�j | ����������_�f���W�J���ɂ��ADNA�̉���w�C���̏C�� | AP�G���h�k�N���A�[�[�A��X��DNA�O���R�V���[�[ | �m���Ă��Ȃ� |
| �k�N���I�`�h�����C�� �iNER�j | ���O���Ǝ˂ł���ꂽDNA�̉��w�C���̏C���BBER�����傫���T�C�Y�̉��w�C�����C���ł��� | XPA CSA | �F�f������� �R�P�C���nj�Q |
| �~�X�}�b�`�C�� �iMMR�j | DNA�������ɐV�����������ꂽDNA����̉���̎�荞�݂̌��i�~�X�}�b�`�j���C�� | MSH�EMLA | �����`�nj�Q�iHNPCC�j �咰���� |
| ����2�{���ؒf ���[�����iend-joining�j | 2�{��DNA�̏C���B B�����p�זE�̍R�̈�`�q��V-J�g�����A�N���X�X�C�b�`�g�����ɂ��g�p����� | DNA�ˑ����v���e�C���L�i�[�[�EKu | �Ɖu�s�S �iT��B�����p�זE�������ł��Ȃ��j |
| �g�����C�� �irecombinational repair�j | 2�{��DNA�̏C�����A�ؒf�[��DNA�Ƃ���̑������F�̂������͎o�����F���̂Ƃ̑����g�����ɂ���čs�� | Rad51�ERad54 Mre11 | �m���Ă��Ȃ� |
| DNA�����`�F�b�N�|�C���g �iDNA�̑�����F���j | �Q�m��DNA�̑�����F�����āA���̑������C�������܂ŁADNA������זE������~������A�������C���ł��Ȃ��זE�ɃA�|�g�[�V�X��U������ | Atm�ENBS�E p53�Ep21 | ���NJg�����^�������� Nijmegen�nj�Q |
| �X�s���h���`�F�b�N�|�C���g �i�זE���ُ̈��F���j | �זE�������Ɏo�����F���̂��e���זE�ɋϓ��ɕ��z�����悤�Ƀ`�F�b�N���� | Bub1�EMad1�E Mad2 | ���F�ُ̂̈���������̈ꕔ |
| �@ | �Տ��Ǐ� |
| �F�f������� �iXP�j | ����F�̐���`�����B���O�����������A�畆�̌����ߕq�Ǐ�i�I�����̐F�f�����Ȃǁj�A�畆����E����������̍����A�i�s���̐��_�_�o�Ǐ������Ƃ��� |
| �R�P�C���nj�Q �iCS�j | �葫�����ΓI�ɒ����A�ڂ������E�����I�ȏ��l�ǂ̏����������B�����ߕq�Ǐ�������� |
| �������R���є�����ُ�� �iTTD�j | ����F�̐���`�����B�є��E���сE�ʖт͂��ׂĂ��낭�A�܂�ł���A�܂̒�`�����ώ@�����B�V�X�e�C���Ȃǂ̊ܗ��A�~�m�_�̌����ɋN������B�܂��A���ɂ͌����ߕq�Ǐ����� |
| �@ | �Տ��Ǐ�E�זE���x���ُ̈� |
| �t�@���R�j�n�� | �����n�̍זE�̌����ȂǁA5�̃T�u�O���[�v������A���ꂼ��Տ��ǏقȂ�B�D������ |
| �u���[���nj�Q | ���R�����̎o�����F���̂������ώ@�����B�D������ |
| ���NJg�����^�������� | �^�������E��̌����Ȃǂ̖э��NJg���B�D�����B �d�����ː��ɑ��銴���� |
| �i�C�~�[�w���nj�Q | �����ǁA�D�����B �d�����ː��ɑ��銴���� |
| �ȉ��̓e�X�g�ɂ͂��܂�W�Ȃ��ł��B�ł��������낢�i�Ƃ������猾�t�͈������j�a�C�Ȃ̂ŁA�e�X�g���I����Ă���ł��ڂ�ʂ��Ă݂Ă��������B |
| SEO | [PR] ����!�����u���O �����z�[���y�[�W�J�� �������C�u���� | ||
