| ��X�̐������ۂ������f�[�^�̃O���t |
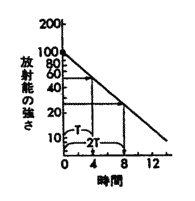
| �Бΐ��O���t�Œ����̌��� |
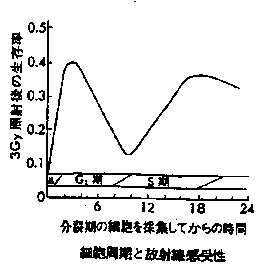
 ������ʉ߂���ԂɁA�����͎U���Ƌz���ɂ��A�i�s�����̋����������Ă���B���̌��ۂ́A1�{1�{�̃����Ō����ꍇ all or nothing ���� independent�i����̃������z�����ꂽ����ƌ����ċz������₷���Ȃ�킯�ł͂Ȃ��݂����Ȃ��Ɓj�̌��ۂ��̌�����͐����̑����ɂ���ĈقȂ邪�A�P���Ȍn�Ƃ��čׂ������ł��P��g���̃����̏ꍇ�ɂ��čl����B��������x������������ʉ߂����Ƃ��A����I����I�����������Ƃ���ƁA���҂̊Ԃɂ́A
������ʉ߂���ԂɁA�����͎U���Ƌz���ɂ��A�i�s�����̋����������Ă���B���̌��ۂ́A1�{1�{�̃����Ō����ꍇ all or nothing ���� independent�i����̃������z�����ꂽ����ƌ����ċz������₷���Ȃ�킯�ł͂Ȃ��݂����Ȃ��Ɓj�̌��ۂ��̌�����͐����̑����ɂ���ĈقȂ邪�A�P���Ȍn�Ƃ��čׂ������ł��P��g���̃����̏ꍇ�ɂ��čl����B��������x������������ʉ߂����Ƃ��A����I����I�����������Ƃ���ƁA���҂̊Ԃɂ́A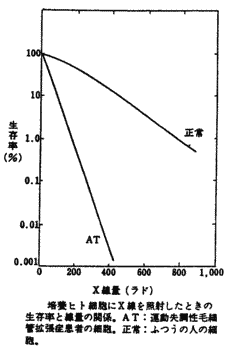 ������F
������F| �@ | 100�̍זE��5���̃f�b�V���ɂ܂� |
| �A | 4���̃f�b�V���ɂ��ꂼ��1�C2�C4�C6Gy�̕��ː��Ǝ˂��s�� |
| �B | 1�`2�T�Ԍ�ɏo������R���j�[���i�f�b�V���ɂ܂��ꂽ1�̍זE���w�����I�ɑ��B���A1�̍זE�R���̎q���זE�̏W�c��1�R���j�[�Ƃ��ē���Ō�����悤�ɂȂ�j���J�E���g���� |
| DNA�����̎�� |
| �����̎�� | ��̗� |
| ����̑��� | T��C�Ȃǂ̃s���~�W���̓��W�J���Ɣ�������ƁA2�d�������Ƃ��H��OH�̕t���������̂�ߎ_�������ł��� |
| T�̃��`�����OH����W�J�����U������ƁACH2OH�̌`�ɂȂ� | |
| C���E�A�~�m���ɂ��U�ɕω�����i����͕��ː��ɂ��炳��Ȃ��Ă����R�ɂ����錻�ۂł���j | |
| A��G�Ȃǂ̃v�����ł�H��OH�̕t���������� | |
| G��C�i8�j�ʂ�OH���ɂ��8-�q�h���L�V�O�A�j�����`������A�זE����ˑR�ψق̌����ƂȂ��Ă���i8-�q�h���L�V�A�f�j�����זE���ł�������`�������j�@��1995�N�x�{��4. | |
| ����̗V���Ɖ���������Ȃ��f�I�L�V���̕��� | �����ꂸ�ɁA����܂��͓��̑����̂��߂ɉ��DNA������V�����邱�Ƃɂ���āA����̔��������ʁiAP�����Ƃ����j��������ƁADNA�������j�Q����A�ꍇ�ɂ���Ă͓ˑR�ψق̌����ƂȂ�i�Ȃ��AAP���ʂ̓A���J�������ŗe�Ղɐؒf�����j |
| DNA�ؒf�i�P���ؒf�܂���2�d���ؒf�j�ɔ����ĉ���̗V����������ꍇ������ | |
| ���ؒf | ���ː��ɂ�铜���i�܂�ɉ���j�̑����ɂ���āADNA2�d�点��̓��̈���ɍ��ؒf��������P���ؒf�Ȃ����́A�����ɐؒf��������2�{���ؒf���`������� |
| �ˋ� crosslink | ������DNA���̉���Ƀ��W�J�����������ꍇ�A����Ԃɋ��L�������`������A�������ˋ������iDNA���ԉˋ��Ƃ����j |
| �Е��̍��̈قȂ�ꏊ�ǂ����ŋ��L������������ꍇ������ADNA�����ˋ��Ƃ��� | |
| �j�^���p�N���̃A�~�m�_��DNA�̉���Ƃ̊Ԃɋ��L�������`�������ꍇ�ADNA-�^���p�N�ԉˋ��Ƃ��� | |
| 2�ʑ̌`���Ǝ��O���ɂ��DNA���� | ���O���i�G�l���M�[���Ⴂ���߁A�ʏ�ł͓d�����������Ȃ��j�Ǝ˂��s���ƁADNA�̉���q�̗�N��������A�s���~�W����DNA��ŕ���ő��݂���ꍇ�A�݂��̊Ԃɋ��L�������`������āA2�ʑ��������i���̑啔���̓V�N���u�^���^�Ƃ�����̂ł��邪�A��V�N���u�^���^�Ƃ�����̂��`�������ꍇ������A���҂Ƃ��זE����ˑR�ψق̌����ƂȂ��Ă���j |
| ���O���Ǝ˂ɂ���ēd�����ː��Ɠ��l��C��T��2�d�������Ƃ�āAH��OH���t������ꍇ������i���͏��Ȃ��j |
| ���B���̍זE�͕��ː��Ǝ˂ɂ���Ď��ɂ₷�� |
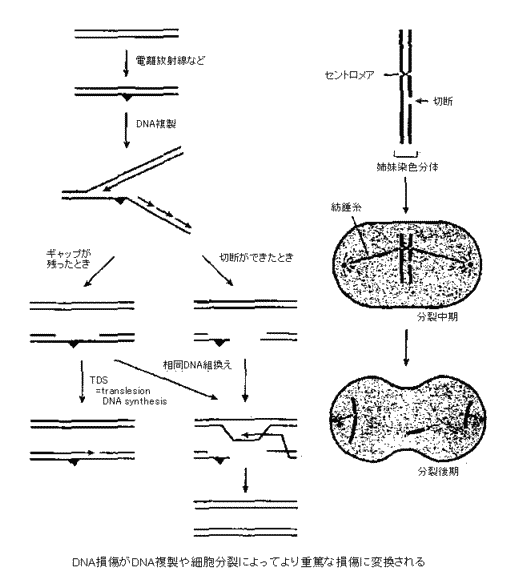
 �d�����ː��́A�x�~���ɂ���זE���܂߂Ă��ׂĂ̎�ނ̍זE�̃Q�m���S�̂ɋϓ��ɑ������������B�x�~���ɂ���זE�ł̓Q�m��DNA�ɑ������������Ă��A���̕����œ]�ʂ��u���b�N�����ȊO�ɁA�זE�ɑ傫�ȃ_���[�W��^���邱�Ƃ͂Ȃ��B�Ƃ��낪�A�����̂���DNA�������������ƁA����Γd�ԁiDNA�|�������[�[�j�����H�i�Е���DNA���j��̏�Q���i�����j�ɂ���đ厖�̂����������H���̂��̂��j�ꂤ��̂ł���B���Ȃ킿�A�Е���DNA����̏����ȑ�����DNA�����ɂ���ĕЕ��̎o�����F���́iDNA�����̌��ʍ��������2�d��DNA�j�̏d�Ăȑ����ɕϊ������킯�ł���B�܂��A2�d���ؒf���������Ă��N���}�`���\���^���p�N���q�ǂ����̑��ݍ�p�ɂ��ؒf�f�[�������ɗ���Ă��܂��킯�ł͂Ȃ��B�Ƃ��낪DNA2�d���ؒf���C������Ȃ��܂܂�M���ɐi�ނƁA�ؒf�̗�����DNA���݂��ɓƗ����ċÏk���邱�Ƃɂ���ăN���}�`���\���^���p�N���q�ǂ����̑��ݍ�p����܂�B�����Ďo�����F���̂̕����̂Ƃ���DNA2�d���ؒf�̒f�[������������A�ؒf�[���ʕ��̌�������F�̓]���̌����ƂȂ肤��B�ȏ���܂Ƃ߂�ƁA���B���̍זE�ł̓Q�m��DNA�̕�������F�̕��z�ɂ���Čy�ǂ�DNA�������d�Ă�DNA�����ɂ����Εϊ�������̂ł���B���̂��߂ɁA�d�����ː���R����܂̃V�X�v���`���ȂǃQ�m��DNA�ɏ�������^�C�v�̎��ẤA����זE���܂ޑ��B�זE���r�I���ٓI�ɎE�����Ƃ��ł���̂ł���B
�d�����ː��́A�x�~���ɂ���זE���܂߂Ă��ׂĂ̎�ނ̍זE�̃Q�m���S�̂ɋϓ��ɑ������������B�x�~���ɂ���זE�ł̓Q�m��DNA�ɑ������������Ă��A���̕����œ]�ʂ��u���b�N�����ȊO�ɁA�זE�ɑ傫�ȃ_���[�W��^���邱�Ƃ͂Ȃ��B�Ƃ��낪�A�����̂���DNA�������������ƁA����Γd�ԁiDNA�|�������[�[�j�����H�i�Е���DNA���j��̏�Q���i�����j�ɂ���đ厖�̂����������H���̂��̂��j�ꂤ��̂ł���B���Ȃ킿�A�Е���DNA����̏����ȑ�����DNA�����ɂ���ĕЕ��̎o�����F���́iDNA�����̌��ʍ��������2�d��DNA�j�̏d�Ăȑ����ɕϊ������킯�ł���B�܂��A2�d���ؒf���������Ă��N���}�`���\���^���p�N���q�ǂ����̑��ݍ�p�ɂ��ؒf�f�[�������ɗ���Ă��܂��킯�ł͂Ȃ��B�Ƃ��낪DNA2�d���ؒf���C������Ȃ��܂܂�M���ɐi�ނƁA�ؒf�̗�����DNA���݂��ɓƗ����ċÏk���邱�Ƃɂ���ăN���}�`���\���^���p�N���q�ǂ����̑��ݍ�p����܂�B�����Ďo�����F���̂̕����̂Ƃ���DNA2�d���ؒf�̒f�[������������A�ؒf�[���ʕ��̌�������F�̓]���̌����ƂȂ肤��B�ȏ���܂Ƃ߂�ƁA���B���̍זE�ł̓Q�m��DNA�̕�������F�̕��z�ɂ���Čy�ǂ�DNA�������d�Ă�DNA�����ɂ����Εϊ�������̂ł���B���̂��߂ɁA�d�����ː���R����܂̃V�X�v���`���ȂǃQ�m��DNA�ɏ�������^�C�v�̎��ẤA����זE���܂ޑ��B�זE���r�I���ٓI�ɎE�����Ƃ��ł���̂ł���B
| ���ː��ɂ��זE�� | |||
| ���B���i������o�Ď��ʁj | �Ԋ����i������o�Ȃ��Ŏ��ʁj | ||
| ���B���x | �������B���� | �������Ƒ��B���邢�͑��B���Ȃ� | |
| ��\�I�ȍזE�̎�� | �������זE�E�����זE�E��ᇍזE�E�|�{�זE�Ȃ� | �����p�� | �̑������זE�E �]�i�_�o�זE�j |
| ���ː����� | ���� | ������1 | �Ⴂ |
| �������Ȑ��i��LET ���ː��Ǝ˂̏ꍇ�j | ��������2 �i�������זE�Ȃǂł͌��Ȃ��j | ���Ȃ���2 �i�A�|�g�[�V�X�j | �H �i�l�N���[�V�X�j |
| �זE���܂ł̎��� | �����ԁ`���� | �����ԁ`1�� | �@ |
| ��LET���ː��iX���E�����j�̐����Ȑ��Ƃ��Âւ̉��p |
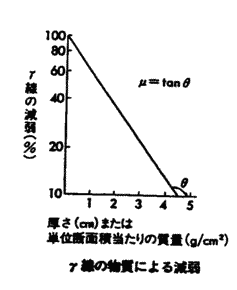
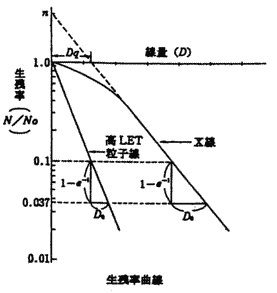 X��������Ȃǂ̒�LET���ː��ł̓��W�J���͑a��ɕ��z���Ă���B���̂Ƃ��͕W�I���q�ɐ����鑹���͊Ԑڍ�p�ɂ���Ă����邱�Ƃ������B����A��LET���ː��̔�Ղ̓C�I�������x�̍����V���[�g�g���b�N���`������B�C�I�������x�������قǁA��Ղ�DNA�Ȃǂ̕W�I���q�Ƃ̒��ړI�ȑ��ݍ�p�̊m���͍����Ȃ�A��LET���ː��ɂ�鑹���͒�LET���ː��������ڍ�p�ɂ���č����m���������B
X��������Ȃǂ̒�LET���ː��ł̓��W�J���͑a��ɕ��z���Ă���B���̂Ƃ��͕W�I���q�ɐ����鑹���͊Ԑڍ�p�ɂ���Ă����邱�Ƃ������B����A��LET���ː��̔�Ղ̓C�I�������x�̍����V���[�g�g���b�N���`������B�C�I�������x�������قǁA��Ղ�DNA�Ȃǂ̕W�I���q�Ƃ̒��ړI�ȑ��ݍ�p�̊m���͍����Ȃ�A��LET���ː��ɂ�鑹���͒�LET���ː��������ڍ�p�ɂ���č����m���������B| ���@ | ���ː��̎�� | ���@�I���� | �o�ϓI���� |
| ���q���Ǝ� | ��LET���ː� �i�z�q�A�d�z�q�A�A���S���E�l�I���Ȃǂ̏d�C�I���A���Β��Ԏq�A�����q���Ȃǁj | �����I�Ȏ�ᇑg�D���ɂ̂݊��S�ȋǏ�������ʂ�^���� | ���ɍ����ȉ����킪�K�v�A���ʂȎ{�݂ł̂ݗ��p�\ |
| �����Ǝ� | ��LET���ː� �i�����EX���E�d�q���Ȃǁj | ��ᇂƐ���g�D�̉\�̍��𗘗p����B��ᇑg�D�Ɋ��S�Ȓv�����ʂ�^���邩���ɁA80�`90���̍זE�v������������ʂ�^���A����g�D�ɂ͉\�ȋǏ��ϗe���ʈȉ���^���� | ��ʓI�ȕ��@ |
| SEO | [PR] ����!�����u���O �����z�[���y�[�W�J�� �������C�u���� | ||
